国药中生武招字第(2017)024号
本公司因经营管理需要,对肠道病毒疫苗室需要的温度验证接头进行公开招标,欢迎具有相应资质的单位前来报名投标。
招标内容:武汉生物制品研究所有限责任公司肠道病毒疫苗室温度验证接头
1.目的
本URS是一份用于欣宁楼肠道病毒疫苗车间NBS生物反应器温度验证接头的关键文件。用于指导设计、施工单位按照我公司的相关要求并结合相关规范进行设计、施工及后期验证等一系列工作。
2.范围
本URS仅用于武汉生物制品研究所有限责任公司欣宁楼肠道病毒疫苗车间NBS生物反应器温度验证接头的购买。
3.职责
|
部 门 |
职 责 |
|
肠道病毒疫苗室 |
负责从用户的角度起草并审核本URS文件。
负责本URS文件的修改、打印,并将纸质版送各相关部门签字。 |
|
项目部 |
负责从项目施工角度审核本URS文件。
负责补充项目施工相关内容。 |
|
工程技术部 |
负责从工程技术角度审核本URS文件。
负责补充工程技术及维护维修相关内容。
负责本URS文件归档。 |
|
生产技术部 |
负责从生产技术角度审核本URS文件。 |
|
质量保证部 |
负责提供URS文件模板。
负责从质量管理法规角度审核本 URS文件。
负责批准本URS文件。 |
4.内容
4.1概述
欣宁楼肠道病毒疫苗车间需要购买2套每套NBS生物反应器温度验证接头,用于肠道病毒疫苗室生物反应器温度验证。
4.2法规要求
4.2.1 GMP要求
《药品生产质量管理规范》(现行版)
《药品GMP指南》无菌药品(现行版)
4.2.2安全及环保要求
BG 8599-2008大型蒸汽灭菌技术要求
4.2.3其他要求
设计、制造及验收符合JB/T44735-1997《钢制焊接常压容器》
4.3安装要求
4.3.1 安装位置
肠道病毒疫苗车间反应器区。
4.3.2安装尺寸
4.3.2.1反应器管道温度验证接头包括3部分,其示意图如下:
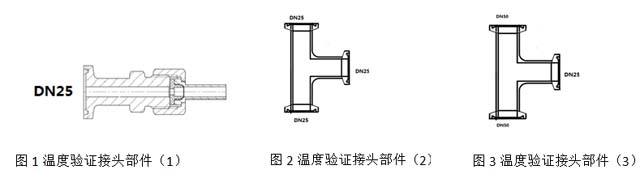
4.3.2.2反应器管道温度验证接头形式尺寸应符合制造商说明书及相关技术图纸规定的要求。
4.3.2.3供应商必须给出反应器管道温度验证接头选型方案及相应附件选型方案,并交给我公司使用部门及工程类部门审核。
4.3.4地面承重
N/A
4.3.5可用的公用系统
N/A
4.3.6洁净级别及房间环境条件
洁净车间C级,环境温度为18~26℃。
4.3.7可用的能源配置
N/A
4.3.8外观及材质要求
4.3.8.1反应器温度验证用接头材质为316L,接口采用国际通用标准快装卡盘式、内胆选用进口316L,内表面镜面抛光,外表面抛亚光、镜面。
4.3.8.2硅胶垫片必须耐高温、耐高压。
4.3.8.3温度探头接头内部有一定的弧度,能够保证热电偶温度探头能够插入且不损害探头。
4.3.8.4三通卡盘接头长度应不超过4cm,T型管道应符合“3D”原则。
4.3.8.5每套反应器温度验证接头主要部件清单如下:
生物反应器部件(1):10个
生物反应器部件(2): 10个
生物反应器部件(3): 5个
4.4运行要求
4.4.1原辅料、包装材料、产品的规格标准
N/A
4.4.2设备效率、产能
N/A
4.4.3工艺参数范围
N/A
4.4.4其他运行要求要求
4.4.4.1热电偶探头能够伸入到反应器管道验证接头内(不能损害探头),并且能够与生物反应器旁路管道的连接。
4.4.4.2热电偶探头和接头、反应器管道连接后,蒸汽在管路中不形成死角,也不造成蒸汽泄漏。
4.5电气、自动控制要求
4.5.1自动控制过程的要求
N/A
4.5.2计算机化系统的验证要求
N/A
4.6安全要求
4.6.1密封及压力保护
4.6.1.1反应器温度验证接头能够耐受4kg以上压力
4.6.1.2反应器温度接头与温度热电偶探头密封性较好,灭菌时不应有蒸汽泄漏。
4.6.2电气保护
N/A
4.7文件要求
4.7.1投标文件、合同及订单。
4.7.2卖方发运清单及相关检验报告。
4.7.3组件清单&说明,包含各组件名称、编号、型号、规格、品牌、材质等。
4.7.4标准技术文件
4.7.5必要的图纸
4.7.6设备厂家文件:出厂测试合格证、相关检测报告、各种标示。
4.7.7材质证书。
4.7.8调试文件:调试计划、调试方案、设备测试记录,检测清单,测试报告,调试总结报告、现场验收报告等。
4.7.9使用操作说明书及维护保养说明(即运行及维护手册)3份。
4.7.10提供使用寿命说明。
4.7.11厂家提供接头材质证明以及NBS生物反应器管道冷点分布等相关验证文件支持。
4.8服务要求
4.8.1培训要求
4.8.1.1设备供应商应免费对设备使用方人员进行反应器温度管道灭菌培训,包括对温度接头的连接与调试,以及注意事项,并填写培训记录。
4.8.1.2生产操作人员培训包括设备结构原理、性能、操作、清洗消毒、故障排除等基本知识。合格标准为用户参加培训人员能够独立正确操作设备,会排除常见故障。
4.8.2运输要求
4.8.2.1设备运输在运输途中需做好防护措施,不得有任何损伤。
4.8.3验证要求
N/A
4.8.4售后服务及备件要求
4.8.4.1设备保质期从确认验收的阶段就开始计算。
4.8.4.2设备质保期为一年,一年内免费保修,一年后应提供良好的售后服务。
4.8.4.3一年免费保修期后,厂家应终生提供及时的维修、维护,厂家应定期回访,解决设备运行当中可能出现的疑问,排除潜在故障,使设备保持良好工作状态。
4.8.4.4厂家应提供合格的备件,用于设备相应部件的维修、更换。
4.8.5验收要求
4.8.5.1货物到达买方使用现场后,由买卖双方共同验收,卖方工程师免费为买房提供调试。
4.8.5.2供应商进厂施工需遵守安全和安装规定。
4.8.5.3确认试车验收合格后,买卖双方签订验收报告。
5.1报名截止日期:2017年04月14日下午3:30时
5.2报名资质:投标人持公司营业执照(副本)、行业许可证、代理厂家的资质信息及授权书、法人委托书、代理人身份证前来报名。
5.3具有履行合同所必需的设备和专业技术能力及提供符合国家要求的合格产品的能力(具有产品经营范围);具有良好的商业信誉和健全的财务会计制度,近2年来,供货同类产品业绩不少于20台。
5.4此项目评标标准是以低价优先原则做为商务部分评选基础,通过评委综合评选后确定中标推荐人。
5.5投标书需准备3份,一正二副,所有投标方制作标书中必须加入反商业贿赂承诺书。否则视为无效标书。 反商业贿赂承诺书.doc
反商业贿赂承诺书.doc
5.6报名前需提前和相关科室/部门做产品技术交流,以确保产品的功能和技术参数符合使用要求,报名时提交带有科室/部门主任签字的确认函。
肠道病毒疫苗室联系人:陈主任 联系方式:13886160132
6.发布人名称:武汉生物制品研究所有限责任公司
6.1联系地址:武汉市江夏区黄金工业园路一号
6.2报名联系人:吴德鑫 汪 洋
联系电话:027-86637028
报名邮箱:wangyang16@sinopharm.com